



業(ye) 務谘詢
中國:
Email: marketing@boboandtiantian.com
業(ye) 務谘詢專(zhuan) 線:400-780-8018
(僅(jin) 限服務谘詢,其他事宜請撥打川沙總部電話)
川沙總部電話: +86 (21) 5859-1500
海外:
+1(781)535-1428(U.S.)
0044 7790 816 954 (Europe)
Email:marketing@medicilon.com



圖源中國科學院上海巴斯德研究所[1]
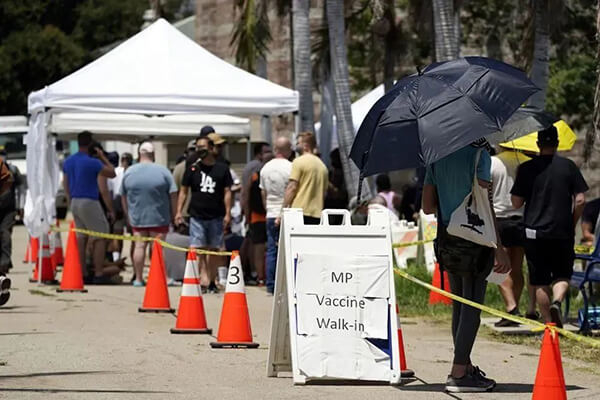
美國舊金山數百人排隊接種猴痘疫苗[2]

○ 該新適應症已在國外獲批:因不存在安全性問題,申報臨(lin) 床隻需提供藥效學試驗證明在動物中的有效性即可。但鑒於(yu) 國外尚未進行人種差異的臨(lin) 床試驗,申報上市時必須提供在中國人中的臨(lin) 床研究,以驗證新的適應症在中國人中的有效性和安全性;
○ 新適應症在國內(nei) 外均未獲批:臨(lin) 床研究按照創新藥的要求;
需延長用藥周期/增加劑量:由於(yu) 用藥窗口期發生改變,可能存在新的安全問題,因此必須重做藥代試驗和安評試驗,特別是有關(guan) 急毒和長毒的毒理研究;
○ 若新適應症擬定的劑量未超過原單次用藥最大劑量:先進行劑量探索試驗,篩選出有效劑量,再擴大試驗驗證藥效和安全性;
○ 若新適應症擬定的劑量超過原單次用藥最大劑量:先進行耐受性試驗,確認劑量的安全範圍,在該範圍中進行劑量探索試驗,篩選出有效劑量,再擴大試驗驗證藥效和安全性;
○ 改變劑型/給藥途徑後根據前體(ti) 藥機製申請適應症:需要重新考察改變劑型後的ADME藥代動力學情況,還有生物利用度情況也是申報的重要依據;
○ 據藥物原先臨(lin) 床前研究時間較久導致官方審評要求已變:根據官方最新要求和指標補充重做一些安評和藥代試驗;
……

[1]https://www.shanghaipasteur.cas.cn/xwdt2016/zhxw2016/202208/t20220808_6497490.html
[2]https://abc7news.com/monkeypox-vaccine-clinic-zuckerberg-san-francisco-general-hospital-doses/12091129/
[3]https://finance.sina.com.cn/jjxw/2022-08-08/doc-imizmscv5311679.shtml
[4] 張傑. (2004). 對申請增加新適應症的思考與(yu) 醫學一般性的技術要求.
 相關新聞
相關新聞